- অষ্টম শ্রেণীর পরিবেশ ও বিজ্ঞান প্রথম অধ্যায় প্রশ্ন উত্তর, Periodic Table in Bengali
- পর্যায় সারণি কাকে বলে
- পর্যায় সারণি এর কিছু বৈশিষ্ট্য
- আধুনিক পর্যায় সারণি
- পর্যায় সারণি ছবি, পর্যায় সারণি ছবি pdf
- মৌলিক পদার্থের নাম ও সংকেত
- মৌলিক ও যৌগিক পদার্থের পার্থক্য
- পর্যায় সারণি মনে রাখার কৌশল
- পর্যায় সারণি, মৌলিক পদার্থের পর্যায় সারণি
- স্বভোজী কাকে বলে, স্বভোজী পুষ্টি কাকে বলে
- স্বভোজী পুষ্টির উদাহরন
- স্বভোজী ও পরভোজী পার্থক্য
- FAQ | Periodic Table in Bengali
অষ্টম শ্রেণীর পরিবেশ ও বিজ্ঞান প্রথম অধ্যায় প্রশ্ন উত্তর, Periodic Table in Bengali
পর্যায় সারণি কাকে বলে
বিভিন্ন মৌলের ভৌত ও রাসায়নিক ধর্মের মধ্যে মিল,অমিল এবং এ সকল ধর্মের ক্রম পরিবর্তন দেখানোর জন্য মৌলসমূহকে কতগুলো আনুভূমিক সারি ও উলম্ব কলামে সাজিয়ে যে তালিকা বা সারনী প্রস্তুত করা হয়েছে তাকে পর্যায় সারণি বলে।
এখনও পর্যন্ত আবিষ্কৃত মৌলগুলোর একই ধর্মবিশিষ্ট মৌলগুলোকে নির্দিষ্ট একটি গ্রুপে রেখে, সকল মৌলের পারমাণবিক সংখ্যার ছোট থেকে বড় এই ক্রমে সাজিয়ে যে সারণি তৈরি করা হযেছে তাকে পর্যায় সারণি বা আধুনিক পর্যায় সারণি বলে।
পর্যায় সারণি এর কিছু বৈশিষ্ট্য
বর্তমানে পর্যায় সারণিতে মোট ১১৮টি মৌলের নাম লেখা আছে। পরবর্তী লেখা পড়ার আগে সামনে একটি পর্যায় সারণির মডেল বের করে নিলে ভালো হয়। পর্যায় সারণির দিকে তাকালেই আমরা কিছু বৈশিষ্ট্য খেয়াল করতে পারবো। যেমন:
- পর্যায় সারণিতে বাম থেকে ডান পর্যন্ত ৭টি পর্যায় বা আনুভূমিক সারি এবং উপর থেকে নিচে ১৮টি গ্রুপ বা খারা স্তম্ভ আছে।
- প্রতিটি পর্যায় বাম দিকে গ্রুপ ১ থেকে শুরু করে ডানদিকে গ্রুপ ১৮ পর্যন্ত বিস্তৃত।
- মূল পর্যায় সারণির নিচে আলাদাভাবে ল্যান্থানাইড ও অ্যাক্টিনাইড সারির মৌল হিসেবে দেখানো হলেও এগুলো যথাক্রমে ৬ এবং ৭ পর্যায়ের অংশ।
| পর্যায় | মৌলের সংখ্যা |
| পর্যায় ১ | ২টি মৌল |
| পর্যায় ২ এবং ৩ | ৮টি মৌল |
| পর্যায় ৪ এবং ৫ | ১৮টি মৌল |
| পর্যায় ৬ এবং ৭ | ৩২টি মৌল |
| গ্রুপ | মৌলের সংখ্যা |
| গ্রুপ ১ | ৭টি মৌল |
| গ্রুপ ২ | ৬টি মৌল |
| গ্রুপ ৩ | ৩২টি মৌল |
| গ্রুপ ৪ থেকে ১২ পর্যন্ত | প্রতি গ্রুপে ৪টি করে মৌল |
| গ্রুপ ১৩ থেকে ১৭ পর্যন্ত | প্রতি গ্রুপে ৬টি করে মৌল |
| গ্রুপ ১৮ | ৭টি মৌল |
আধুনিক পর্যায় সারণি
পর্যায় সারণি একজন বিজ্ঞানীর একদিনের পরিশ্রমের ফলে তৈরি হয়নি। অনেক বিজ্ঞানীর অনেক দিনের অক্লান্ত পরিশ্রমের ফলে আজকের এই আধুনিক পর্যায় সারণি তৈরি হয়েছে।
1789 সালে ল্যাভয়সিয়ে অক্সিজেন, নাইট্রোজেন, হাইড্রোজেন, ফসফরাস, মার্কারি, জিংক এবং সালফার ইত্যাদি মৌলিক পদার্থসমূহকে ধাতু ও অধাতু এই দুই ভাগে ভাগ করেন।
ল্যাভয়সিয়ের সময় থেকেই মৌলগুলোকে বিভিন্ন ভাগে ভাগ করার চিন্তা ভাবনা শুরু হয় যেন একই ধরনের মৌলিক পদার্থগুলো একটি নির্দিষ্ট ভাগে থাকে।
1829 সালে বিজ্ঞানী ডোবেরাইনার লক্ষ করেন তিনটি করে মৌলিক পদার্থ একই রকমের ধর্ম প্রদর্শন করে। তিনি প্রথমে পারমাণবিক ভর অনুসারে তিনটি করে মৌল সাজান।
এরপর তিনি লক্ষ করেন দ্বিতীয় মৌলের পারমাণবিক ভর প্রথম ও তৃতীয় মৌলের পারমাণবিক ভরের যোগফলের অর্ধেক বা তার কাছাকাছি, একে ডোবেরাইনারের ত্রয়ীসূত্র বলে।
বিজ্ঞানী ডোবেরাইনার ক্লোরিন, ব্রোমিন ও আয়োডিনকে প্রথম ত্রয়ী মৌল হিসেবে চিহ্নিত করেন।
1864 সাল পর্যন্ত আবিষ্কৃত মৌলসমূহের জন্য নিউল্যান্ড অষ্টক সূত্র নামে একটি সূত্র প্রদান করেন। এই সূত্র অনুযায়ী মৌলসমূহকে যদি পারমাণবিক ভরের ছোট থেকে বড় অনুযায়ী সাজানো যায় তবে যেকোনো একটি মৌলের ধর্ম তার অষ্টম মৌলের ধর্মের সাথে মিলে যায়।
1869 সালে রাশিয়ান বিজ্ঞানী মেন্ডেলিফ সকল মৌলের ধর্ম পর্যালোচনা করে একটি পর্যায় সূত্র প্রদান করেন। সূত্রটি হলো: “মৌলসমূহের ভৌত ও রাসায়নিক ধর্মাবলি তাদের পারমাণবিক ভর বৃদ্ধির সাথে পর্যায়ক্রমে আবর্তিত হয়।”
এ সূত্র অনুসারে তিনি তখন পর্যন্ত আবিষ্কৃত 63 টি মৌলকে 12 টি আনুভূমিক সারি আর ৪ টি খাড়া কলামের একটি ছকে পারমাণবিক ভর বৃদ্ধি অনুসারে সাজিয়ে দেখান যে, একই কলাম বরাবর সকল মৌলগুলোর ধর্ম একই রকমের এবং একটি সারির প্রথম মৌল থেকে শেষ মৌল পর্যন্ত মৌলগুলোর ধর্মের ক্রমান্বয়ে পরিবর্তন ঘটে।
এই ছকের নাম দেওয়া হয় পর্যায় সারণি (Periodic Table)।
পর্যায় সারণি ছবি, পর্যায় সারণি ছবি pdf
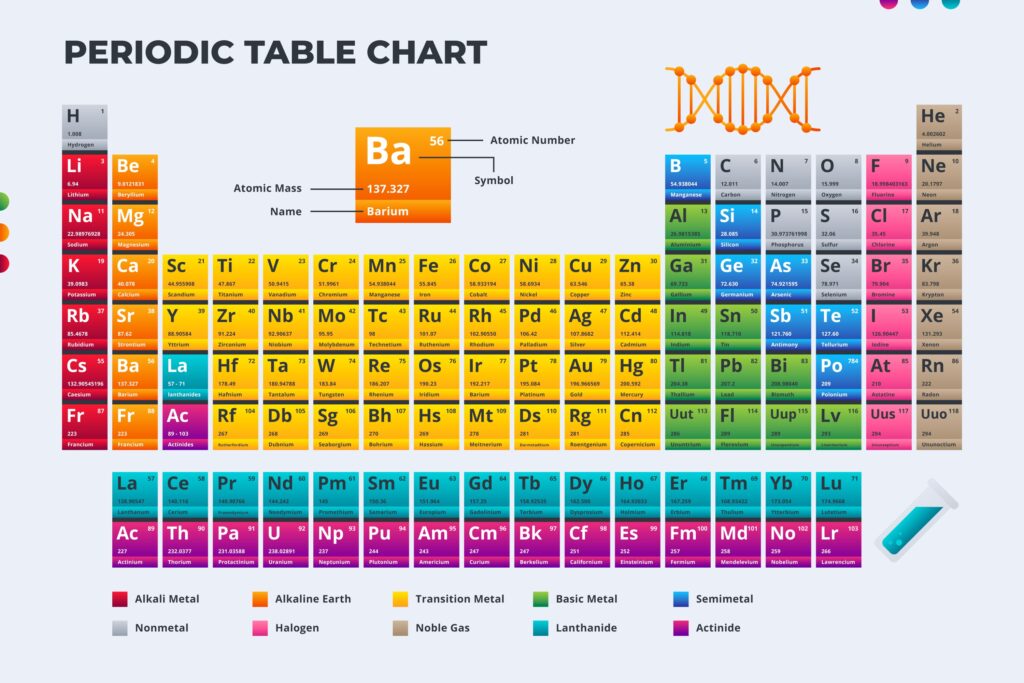
মৌলিক পদার্থের নাম ও সংকেত
বহু আগে থেকে মানুষ বিভিন্ ধরনের মৌলিক পদার্থ ব্যবহার করে আসছে। জৈবিক কারণে মানুষ অক্সিজেন গ্রহণ কারণে বাতাস থেকে সংগ্রহ করে। বিভিন্ন প্রয়োজনে মানুষ লোহা, তামা, দস্তা ইত্যাদি ধাতব মৌলিক পদার্থ ব্যবহার করে আসছে, অনেক কাল আগে থেকে।
তাই অনেকগুলো মৌলিক পদার্থের নাম মানুষ নিজের মতো করে প্রদান করেছে। ভাষাভেদে এই সব পদার্থের নামও ভিন্ন ভিন্ন রকমের। তবে এই সব পদার্থ যে মৌলিক পদার্থ বা কেন যৌগিক পদার্থ নয় এবং এই জ্ঞান মানুষ লাভ করেছে বিভিন্ন গবেষণার ক্ষেত্রে। এই গবেষণার সূত্রে নতুন মৌলিক পদার্থ হিসাবে যেগুলোকে শনাক্ত করা হয়েছে, তার তালিকা নিচে দেওয়া হলো।
মৌলিক ও যৌগিক পদার্থের পার্থক্য
মৌলিক ও যৌগিক পদার্থের মধ্যে পার্থক্য নিম্নরূপঃ
- ১। যে পদার্থকে রাসায়নিক পদ্ধতিতে বিভাজিত করে দুই বা ততোধিক ভিন্ন ধর্মবিশিষ্ট পদার্থে বিশ্লিষ্ট করা যায় না, অর্থাৎ যে পদার্থ হতে সাধারণভাবে সেই পদার্থ ব্যতীত অন্য কোন নূতন পদার্থ পাওয়া যায় না, তাকে মৌল বা মৌলিক পদার্থ বলে। পক্ষান্তরে, যে পদার্থ থেকে দুই বা ততোধিক সম্পূর্ণ ভিন্ন ধর্মবিশিষ্ট মৌলিক পদার্থ পাওয়া যায়, সেই পদার্থকে যৌগ বা যৌগিক পদার্থ বলে।
- ২। মৌলিক পদার্থ হলো- কার্বন, হাইড্রোজেন, লৌহ ইত্যাদি। আর, যৌগিক পদার্থ হলো- পানি, এসিড, লবন ইত্যাদি।
- ৩। মৌলিক পদার্থের একক হলো- পরমানু। আর, যৌগিক পদার্থের একক- অনু।
- ৪। মৌলিক পদার্থকে বিশ্লেষন করলে ইলেকট্রন, প্রোটন ও নিউট্রন পাওয়া যায়। আর, যৌগিক পদার্থকে বিশ্লেষন করলে মৌলিক পদার্থ পাওয়া যায়।
- ৬। মৌলিক পদার্থের সংখ্যা সীমিত। কিন্তু, যৌগিক পদার্থের সংখ্যা অসীম হিসেবে বিবেচনা করা হয়।
- ৭। যেসব পদার্থকে বিশ্লেষণ করলে ঐ পদার্থ ছাড়া অন্য কোন পদার্থ পাওয়া যায় না সেই পদার্থকে মৌলিক পদার্থ বলে। অপরদিকে, যেসব পদার্থকে বিশ্লেষণ করলে একাধিক ভিন্ন পদার্থ পাওয়া যায় সেই পদার্থ গুলিকে যৌগিক পদার্থ বলে।
- ৮। মৌলিক পদার্থ গুলি একই মৌলের একাধিক পরমাণুর সমন্বয়ে গঠিত। কিন্তু, যৌগিক পদার্থ একাধিক ভিন্ন মৌলের পরমাণুর সমন্বয়ে গঠিত। উদাহরণঃ হাইড্রোজেন অণুকে (H₂) বিশ্লেষণ করলে শুধু হাইড্রোজেন পাওয়া যায়। সুতরাং হাইড্রোজেন একটি মৌলিক পদার্থ। অপরদিকে, পানিকে (H₂O) বিশ্লেষণ করলে দুটি হাইড্রোজেন পরমাণু ও একটি অক্সিজেন পরমাণু পাওয়া যায়। সুতরাং পানি একটি যৌগিক পদার্থ।
পর্যায় সারণি মনে রাখার কৌশল
কিছু পর্যায় সারণি মনে রাখার কৌশল আছে যার মাধ্যমে আমরা সহজেই মৌলগুলোর নাম মনে রাখতে পারি। এর মাঝে একটি উপায় হলো ছন্দের মাধ্যমে মৌলগুলোর নাম মনে রাখা। কবিতা কিংবা গানের ছন্দ মনে রাখা আমাদের জন্য খুবই সহজ কাজগুলোর একটি। হালকা চর্চা করলেই এগুলো সহজে আমাদের মনে পড়ে। তাই কিছু ছন্দের মাধ্যমে আমরা পর্যায় সারণির মৌলগুলোর নাম মনে রাখার চেষ্টা করবো।
গ্রুপ ১ – হায় – H – হাইড্রোজেন
লি – Li – লিথিয়াম
না – Na – সোডিয়াম
কে – K – পটাশিয়াম
রুবি – Rb – রুবিডিয়াম
ছেঁচে – Cs – সিজিয়াম
ফেলেছে – Fr – ফ্রানসিয়াম
গ্রুপ ২ – বিরিয়ানি – Be – বেরিলিয়াম
মোগলাই – Mg – ম্যাগনেসিয়াম
কাবাব – Ca – ক্যালসিয়াম
সরিয়ে – Sr – স্ট্রোনসিয়াম
বাটিতে – Ba – বেরিয়াম
রাখো – Ra – রেডিয়াম
গ্রুপ ১৩ – বো – B – বোরন
য়াল – Al – অ্যালুমিনিয়াম
গেলো – Ga – গ্যালিয়াম
ইন্ডিয়া – In – ইনডিয়াম
তেও যাই – Ti – থ্যালিয়াম
গ্রুপ ১৪ – কাল – C – কার্বন
সিলেট – Si – সিলিকন
গেলে – Ge – জারমেনিয়াম
স্বর্ন – Sn – টিন
পাবো – Pb – লেড
গ্রুপ ১৫ – নানা – N – নাইট্রোজেন
পাটেকার – P – ফসফরাস
আসলো – As – আর্সেনিক
সব – Sb – অ্যান্টিমনি
বিলিয়ে – Bi – বিসমাথ
গ্রুপ ১৬ – ও – O – অক্সিজেন
এস – S – সালফার
এস সি – Se – সেলেনিয়াম
তে – Te – টেলুরিয়াম
পড়ে – Po – পোলোনিয়াম
গ্রুপ ১৭ – ফকিরা – F – ফ্লোরিন
কালু – Cl – ক্লোরিন
বরিসাল থেকে – Br – ব্রোমিন
ইস্টিমারে – I – আয়োডিন
আসতেসে – At – অ্যাস্টাটিন
গ্রুপ ১৮ – হিলি – He – হিলিয়াম
নিয়ন্তা – Ne – নিয়ন
আর – Ar – আর্গন
কিশোর – Kr – ক্রিপ্টন
যাবে – Xe – জেনন
রংপুর – Rn – রেডন
পর্যায় ৩ – না – Na – সোডিয়াম
মাযে – Mg – ম্যাগনেসিয়াম
এসে – Al – অ্যালুমিনিয়াম
সিজদায় – Si – সিলিকন
পড়ে – P – ফসফরাস
সবাই – S – সালফার
কালেমা – Cl – ক্লোরিন
আওড়ায় – Ar – আর্গন
পর্যায় সারণি, মৌলিক পদার্থের পর্যায় সারণি
| গ্রুপ→ | ১ | ২ | ৩ | ৪ | ৫ | ৬ | ৭ | ৮ | ৯ | ১০ | ১১ | ১২ | ১৩ | ১৪ | ১৫ | ১৬ | ১৭ | ১৮ |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| পর্যায় | ||||||||||||||||||
| ১ | ১ H | ২ He | ||||||||||||||||
| ২ | ৩ Li | ৪ Be | ৫ B | ৬ C | ৭ N | ৮ O | ৯ F | ১০ Ne | ||||||||||
| ৩ | ১১ Na | ১২ Mg | ১৩ Al | ১৪ Si | ১৫ P | ১৬ S | ১৭ Cl | ১৮ Ar | ||||||||||
| ৪ | ১৯ K | ২০ Ca | ২১ Sc | ২২ Ti | ২৩ V | ২৪ Cr | ২৫ Mn | ২৬ Fe | ২৭ Co | ২৮ Ni | ২৯ Cu | ৩০ Zn | ৩১ Ga | ৩২ Ge | ৩৩ As | ৩৪ Se | ৩৫ Br | ৩৬ Kr |
| ৫ | ৩৭ Rb | ৩৮ Sr | ৩৯ Y | ৪০ Zr | ৪১ Nb | ৪২ Mo | ৪৩ Tc | ৪৪ Ru | ৪৫ Rh | ৪৬ Pd | ৪৭ Ag | ৪৮ Cd | ৪৯ In | ৫০ Sn | ৫১ Sb | ৫২ Te | ৫৩ I | ৫৪ Xe |
| ৬ | ৫৫ Cs | ৫৬ Ba | * | ৭২ Hf | ৭৩ Ta | ৭৪ W | ৭৫ Re | ৭৬ Os | ৭৭ Ir | ৭৮ Pt | ৭৯ Au | ৮০ Hg | ৮১ Tl | ৮২ Pb | ৮৩ Bi | ৮৪ Po | ৮৫ At | ৮৬ Rn |
| ৭ | ৮৬ Fr | ৮৮ Ra | ** | ১০৪ Rf | ১০৫ Db | ১০৬ Sg | ১০৬ Bh | ১০৮ Hs | ১০৯ Mt | ১১০ Ds | ১১১ Rg | ১১২ Cn | ১১৩ Uut | ১১৪ Fl | ১১৫ Mc | ১১৬ Lv | ১১৭ Ts | ১১৮ Og |
স্বভোজী কাকে বলে, স্বভোজী পুষ্টি কাকে বলে
স্বভোজী পুষ্টি: বেশিরভাগ সবুজ উদ্ভিদরা পরিবেশ থেকে খাদ্য উপাদান যেমন জল, কার্বন ডাই-অক্সাইড, খনিজ পদার্থ সংগ্রহ করে এবং সূর্যালোকের উপস্থিতিতে ক্লোরোফিলের সাহায্যে নিজেদের দেহে শর্করা জাতীয় খাদ্য সংশ্লেষ করে। ওই সংশ্লেষিত খাদ্যের আত্তীকরণের ফলে উদ্ভিদের বৃদ্ধি হয় ও শুষ্ক ওজন বাড়ে। এরূপ ভাবে নিজেদের দেহে খাদ্য উৎপন্ন করে পুষ্টি সাধনকে স্বভোজী পুষ্টি বলে।
সংজ্ঞা: যে পুষ্টি প্রক্রিয়ায় জীবেরা তাদের নিজেদের দেহে খাদ্য সংশ্লেষ করে পুষ্টি সম্পন্ন করে, তাকে স্বভোজী পুষ্টি বা অটোট্রফিক পুষ্টি বলে।
স্বভোজী পুষ্টির উদাহরন
সবুজ উদ্ভিদের (যেমন: আম গাছ, ধান গাছ, অর্কিড, শৈবাল ইত্যাদি) এবং এককোষী প্রাণী ইউগ্লিনা, ক্রাইসেমিবা প্রভৃতির পুষ্টি।
স্বভোজী ও পরভোজী পার্থক্য
- স্বভোজীঃ যে সকল জীব নিজেরাই খাদ্য উৎপাদন করতে পারে এবং নিজেদের খাদ্যের যোগান নিজেরাই করতে পারে, তাদের স্বভোজী জীব বলা হয়। পৃথিবীতে একমাত্র উদ্ভিদ এবং কিছু প্রজাতির ব্যাক্টেরিয়া (সায়ানোব্যাক্টেরিয়া বা নীলাভ সবুজ শৈবাল) হল স্বভোজী জীব। সালোকসংশ্লেষণের মাধ্যমে এরা নিজেরাই নিজেদের খাদ্য উৎপাদন করতে পারে এবং গ্রহণ করতে পারে।
- পরভোজীঃ যে সকল জীব নিজেদের খাদ্য উৎপাদন করতে পারে না, খাদ্য গ্রহণের জন্য অন্য জীবের উপর নির্ভরশীল তাদের পরভোজী বলা হয়। উদ্ভিদ ব্যতীত সকল জীব পরভোজী।
FAQ | Periodic Table in Bengali
Q1. পদার্থের চতুর্থ অবস্থার নাম কি
Ans – পদার্থের চতুর্থ অবস্থা হিসাবে প্লাজমা বিবেচিত হয়। পদার্থের অন্যান্য মৌলিক অবস্থা হল তরল, কঠিন পদার্থ এবং গ্যাস।
Q2. পদার্থের রাসায়নিক ধর্মের জন্য দায়ী কোন কণা
Ans – এক ধরণের পদার্থের অন্য ধরণের পরিবর্তন (বা পরিবর্তনের অক্ষমতা) একটি রাসায়নিক সম্পত্তি। রাসায়নিক বৈশিষ্ট্যের উদাহরণগুলির মধ্যে রয়েছে জ্বলনযোগ্যতা, বিষাক্ততা, অম্লতা, প্রতিক্রিয়াশীলতা (অনেক ধরণের) এবং জ্বলনের উত্তাপ।
Q3. কোন পদার্থের আপেক্ষিক তাপ সবচেয়ে বেশি
Ans – জলের আপেক্ষিক তাপ সবচেয়ে বেশি।

মধ্য শিক্ষা পরিষদ বা ওয়েস্ট বেঙ্গল বোর্ড অফ সেকেন্ডারি এডুকেশন (ডব্লিউবিবিএসই) দ্বারা নির্ধারিত শারীরিক বিজ্ঞান এবং পরিবেশের ক্লাস নাইন সিলেবাসের উপর ভিত্তি করে সান্ত্রা পাবলিকেশনের পাঠ্যপুস্তক সিরিজের খাঁটি বাংলা সংস্করণ পাঠ্যপুস্তক।.




