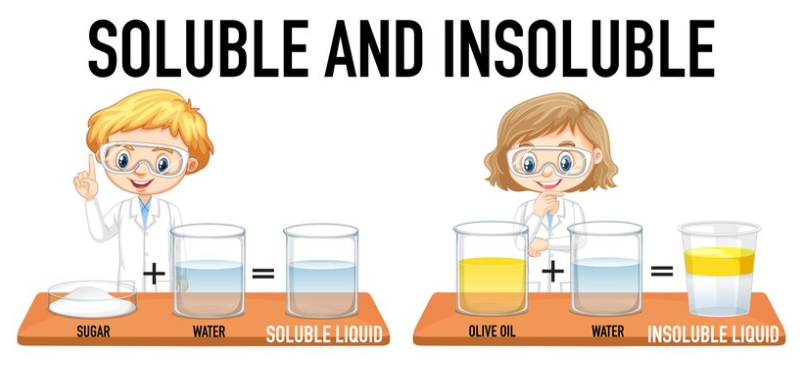
দ্রাব্যতা কি
সাম্যাবস্থায় একটি দ্রাবকে যে সর্বাধিক পরিমাণ দ্রব দ্রবীভূত করা যায়, তাকে দ্রাব্যতা বলে।
কোনো নির্দিষ্ট তাপমাত্রায় যত গ্রাম দ্রব 100 g দ্রাবকে দ্রবীভূত হয়ে সম্পৃক্ত দ্রবণ তৈরি করে সেই ভর প্রকাশক সংখ্যাকে ঐ তাপমাত্রায় ঐ দ্রবের দ্রাব্যতা বলে।
দ্রাব্যতা পদার্থের একটি ভৌত ধর্ম।
কোন পদার্থের দ্রাব্যতা প্রকৃতপক্ষে ব্যবহৃত দ্রাবক, তাপমাত্রা ও চাপের উপর নির্ভর করে।
দ্রাব্যতা চারটি বিষয়ের উপর নির্ভর করে। সেগুলো হলো –
- দ্রবের প্রকৃতি,
- দ্রাবকের প্রকৃতি,
- চাপ এবং
- তাপমাত্রা।
দ্রাব্যতা কাকে বলে
দ্রাব্যতা পদার্থের একটি ভৌত ধর্ম। কোন নির্দিষ্ট তাপমাত্রায় নির্দিষ্ট পরিমাণ দ্রাবককে সম্পৃক্ত দ্রবণে পরিণত করতে যে পরিমাণ দ্রব দ্রবীভূত করতে হয় তাকেই ঐ তাপমাত্রায় ঐ দ্রবের দ্রাব্যতা বলে। কোন পদার্থের দ্রাব্যতা প্রকৃতপক্ষে ব্যবহৃত দ্রাবক, তাপমাত্রা ও চাপের উপর নির্ভর করে।
কোন নির্দিষ্ট তাপমাত্রায় নির্দিষ্ট পরিমাণ দ্রাবককে সম্পৃক্ত দ্রবণে পরিণত করতে যে পরিমাণ দ্রব দ্রবীভূত করতে হয় তাকেই ঐ তাপমাত্রায় ঐ দ্রবের দ্রাব্যতা বলে।
যেমনঃ 35° সে. তাপমাত্রায় KNO3 এর দ্রাব্যতা হল 60 তাহলে বোঝা যাবে যে ঐ তাপমাত্রায় 100g পানিতে সর্বাধিক 60g KNO3 দ্রবীভূত হয়ে দ্রবণ উৎপন্ন করবে ।
দ্রাব্যতার সূত্র, দ্রাব্যতা নির্ণয়ের সূত্র
ধরা যাক, t⁰C-তে ‘a’ গ্রাম দ্রাবক সর্বাধিক ‘b’ গ্রাম দ্রবণকে দ্রবীভূত করে একটি সম্পৃক্ত দ্রবণ তৈরি করে, তাহলে t⁰C এ সেই দ্রাবকের দ্রবণীয়তা হল –
দ্রাব্যতা=দ্রবের ভর/দ্রাবকের ভর ×১০০
দ্রাব্যতা গুণফল কি
কোনো নির্দিষ্ট তাপমাত্রায় কোনো স্বল্প দ্রবণীয় তড়িৎ বিশ্লেষ্য লবণের সম্পৃক্ত দ্রবণে উৎপন্ন আয়নসমূহ যখন অদ্রবীভূত তড়িৎ বিশ্লেষ্যের সাথে সাম্যাবস্থায় থাকে তখন এর ধনাত্মক ও ঋণাত্মক আয়নদ্বয়ের যথোপযুক্ত ঘাতসহ ঘনমাত্রার গুণফলকে সংশ্লিষ্ট লবণের দ্রাব্যতা গুণফল বলে।
দ্রাব্যতা গুণফলের বৈশিষ্ট্য
- নির্দিষ্ট তাপমাত্রায় কোনো স্বল্পদ্রাব্য লবণের দ্রাব্যতা গুণফলের মান সর্বদা ধ্রুবক। তাপমাত্রার পরিবর্তনে দ্রাব্যতা গুণফলের মান পরিবর্তিত হয়।
- স্থির তাপমাত্রায় স্বল্পদ্রাব্য লবণের সম্পৃক্ত দ্রবণে লবণ থেকে উৎপন্ন আয়নগুলোর ঘনমাত্রার পরিবর্তন করলে দ্রাব্যতা গুণফল অপরিবর্তিত থাকে। এমনকি দ্রবণে অন্য কোনো আয়ন উপস্থিত থাকলেও যোগটির দ্রাব্যতা গুণফলের মানের কোনো পরিবর্তন হয় না।
দ্রাব্যতা গুণফল কাকে বলে
নির্দিষ্ট তাপমাত্রায় কোনো স্বল্প দ্রবণীয় লবণের দ্রবণে তার উপাদান আয়নসমুহের ঘাত সহ ঘনমাত্রার সর্বোচ্চ গুণফলককে লবণটির দ্রাব্যতা গুণফল বলে। এটি একটি ধ্রুবক। এর কোন একক নেই একে Ksp দ্বারা প্রকাশ করা হয়। Ksp হলো কোনাে দ্রবণে একটি নির্দিষ্ট তাপমাত্রায় দ্রবীভূত হতে পারে এমন পরিমাণ লবণের আয়নসমূহের ঘাত সহ ঘনমাত্রার গুণফল।
সম্পৃক্ত দ্রবণের আয়নিক গুণফল হলো দ্রাব্যতা গুণফল । নির্দিষ্ট দ্রবণে Ksp এর মান তাপমাত্রার উপর নির্ভরশীল। তাপমাত্রা বৃদ্ধি পেলে Ksp বৃদ্ধি পায়, তাপমাত্রা হ্রাস পেলে Ksp হ্রাস পায়। কোনো নির্দিষ্ট ক্ষেত্রে Kip যদি Ksp বেশি হয়, তাহলে দ্রবণটি অতিপৃক্ত, অর্থাৎ লবণের পরিমাণ বেশি। এজন্য দ্রবণে লবণটির অধঃক্ষেপ পড়বে। যদি Kip Ksp এর সমান হয়, তাহলে দ্রবণটি সম্পৃক্ত। যদি Kip Ksp এর কম হয় দ্রবণে আরোও লবণ যোগ করা যাবে।
দ্রাব্যতা গুণফল নির্ণয়ের সূত্র
মনে করি, একটি স্বল্পদ্রাব্য লবণ AB এর সম্পৃক্ত জলীয় দ্রবণে অদ্রবীভূত কঠিন AB এবং দ্রবীভূত AB এর বিয়োজনে উৎপন্ন A+ ও B– আয়নের মধ্যে গঠিত সাম্যাবস্থা হলো-
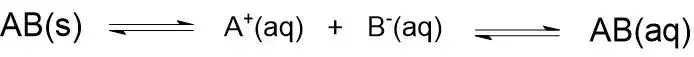
এই সাম্যাবস্থার ক্ষেত্রে ভরক্রিয়া সূত্র প্রয়োগ করে পাই, সাম্যধ্রুবক, K = [A+]x[B–]/[AB]
যেখানে, [A+], [B–] ও [AB] হল সাম্যাবস্থায় যথাক্রমে A+ , B– এবং AB এর মোলার ঘনমাত্রা।
স্থির তাপমাত্রায় বিশুদ্ধ কঠিন পদার্থের মোলার ঘনমাত্রা ধ্রুবক হয়। আবার, স্থির তাপমাত্রায় সাম্যধ্রুবকের মান ও ধ্রুবক হয়। সুতরাং, নির্দিষ্ট তাপমাত্রায় K x [AB] = ধ্রুবক হবে।
সুতরাং, K x [AB] = [A+]x[B–]
বা, Ksp = [A+]x[B–] [sp = solubility product], যেখানে, Ksp = K x [AB]
এটিই স্বল্প দ্রাব্য লবণের দ্রাব্যতা গুনফলের গানিতিক সমীকরণ।
দ্রাব্যতার উপর তাপমাত্রার প্রভাব ব্যাখ্যা কর
সাধারণত তাপমাত্রা বৃদ্ধিতে দ্রবের দ্রাব্যতা বৃদ্ধি পায়। আবার তাপমাত্রা হ্রাসের সাথে সাথে দ্রাব্যতা হ্রাস পায়। ব্যতিক্রম NaOH; এর ক্ষেত্রে তাপমাত্রা বৃদ্ধি করলে দ্রবের দ্রাব্যতা হ্রাস পায়। তাপমাত্রা বৃদ্ধিতে দ্রাব্যতার ক্ষেত্রে নিম্নলিখিত পর্যবেক্ষণ পরিলক্ষিত হয়।
১। KNO3, NaNO3, KCl, Pb(NO3)2, K2CO3 প্রভৃতি দ্রবের ক্ষেত্রে তাপমাত্রা বৃদ্ধির সাথে সাথে দ্রাব্যতা বৃদ্ধি পায়। তবে KNO3 এর দ্রাব্যতা বৃদ্ধির হার অন্যসব দ্রব অপেক্ষা বেশি ।
২। NaCl এর ক্ষেত্রে দ্রাব্যতার উপর তাপমাত্রার তেমন কোনো প্রভাব নেই ।
দ্রাব্যতা ও দ্রাব্যতা গুণফল এর সম্পর্ক
- প্রতি ১০০ গ্রাম পানিতে বা কোনো দ্রাব্যকে গ্রামে প্রকাশিত ওজনে সর্বোচ্চ যে পরিমাণ কোনো দ্রব্য দ্রবীভূত করা যায়, তাকে ঐ দ্রব্যের দ্রাব্যতা (S) বলে। কিন্তু কোনো স্বল্প দ্রবণীয় পদার্থ হতে উৎপন্ন সকল আয়নের ঘনমাত্রা (উপযুক্ত ঘাত বিশিষ্ট) সর্বোচ্চ গুণফলকে দ্রাব্যতা গুনফল (Ks) বলা হয়।
- দ্রাব্যতা সকল প্রকার পদার্থের ক্ষেত্রে প্রযোজ্য। কিন্তু দ্রাব্যতা গুণফল কেবল স্বল্প দ্রবণীয় তড়িৎ বিশ্লেষ্যের ক্ষেত্রে প্রযোজ্য।
- দ্রাব্যতা সমআয়নের (Common ion) প্রভাবে পরিবর্তিত হয়। কিন্তু দ্রাব্যতা গুণফল সমআয়নের প্রভাবে পরিবর্তিত হয় না।
- উভয় রাশিই তাপমাত্রার দ্বারা সমানভাবে প্রভাবিত হয়।
দ্রাব্যতা এবং দ্রাব্যতার গুণফলের মধ্যে পার্থক্য
১। দ্রাব্যতা সকল ধরনের পদার্থ যেমন- স্বল্প দ্রবণীয় বা সম্পূর্ণরূপে দ্রবণীয় লবণের ক্ষেত্রে প্রযোজ্য। কিন্তু দ্রাব্যতার গুণফল শুধুমাত্র স্বল্প দ্রবণীয় লবণের সম্পৃক্ত দ্রবণের ক্ষেত্রে প্রযোজ্য।
২। তড়িৎ বিশ্লেষ্য এবং তড়িৎ অবিশ্লেষ্য উভয় ধরনের পদার্থের ক্ষেত্রেই দ্রাবত্য প্রযোজ্য। কিন্তু দ্রাব্যতার গুণফল শুধুমাত্র তড়িৎ বিশ্লেষ্য পদার্থের ক্ষেত্রে প্রযোজ্য ।
৩। সমআয়ন প্রভাবের ফলে দ্রাব্যতার পরিবর্তন হলেও দ্রাব্যতার গুণফল অপরিবর্তিত থাকে।
৪। তাপমাত্রা পরিবর্তনের ফলে দ্রাব্যতা ও দ্রাব্যতার গুণফল উভয়ই পরিবর্তিত হয়।
৫। সাধারণত স্থির তাপমাত্রায় 100g দ্রাবকে যত গ্রাম দ্রব দ্রবীভূত করে সম্পক্ত দ্রবণ তৈরি করা যায় সেই পরিমাণ দ্বারা দ্রাব্যতা নির্ণয় করা যায়। তাই একে গ্রাম/ লিটার বা মোল/ লিটার এককেও প্রকাশ করা হয়। তবে স্থির তাপমাত্রায় স্বল্প দ্রবণীয় লবণের সম্পৃক্ত দ্রবণে আয়নসমূহের যথোপযুক্ত ঘাতবিশিষ্ট ঘনমাত্রার গুণফল দ্বারা দ্রাব্যতার গুণফল হিসাব করা হয়।
আরো অন্যান্য অতি জনপ্রিয় প্রশ্নোত্তর সম্পর্কে জানার জন্য এখানে ক্লিক করুন FAQ | দ্রাব্যতা
Q1. যৌগের দ্রাব্যতা কি
Ans – দ্রাব্যতা হল দ্রবণীয় অণু এবং দ্রাবক অণুর মধ্যে নতুন বন্ধন গঠন। পরিমাণের পরিপ্রেক্ষিতে, দ্রবণীয়তা হল দ্রাবকের সর্বাধিক ঘনত্ব যা একটি নির্দিষ্ট তাপমাত্রায় দ্রাবকের পরিচিত ঘনত্বে দ্রবীভূত হয়।
Q3. দ্রাব্যতা নীতি কি
Ans – দ্রবণীয়তা হল একটি পদার্থের ক্ষমতা, যা একটি দ্রাবক হিসাবে পরিচিত, একটি দ্রাবকের মধ্যে দ্রবীভূত হয়ে একটি সমজাতীয় মিশ্রণ তৈরি করে যাকে দ্রবণ বলা হয়।
আপনি কি চাকরি খুজঁছেন, নিয়মিত সরকারি ও বেসরকারি চাকরির সংবাদ পেতে ক্লিক করুন। বিভিন্ন সরকারি ও বেসরকারি ক্ষেত্রে মানব সম্পদ উন্নয়ন সংক্রান্ত প্রতিবেদন পাড়ার জন্য, ক্লিক করুন। হিন্দিতে শিক্ষামূলক ব্লগ পড়তে, এখানে ক্লিক করুন। এছাড়াও, স্বাস্থ, টেকনোলজি, বিসনেস নিউস, অর্থনীতি ও আরো অন্যান্য খবর জানার জন্য, ক্লিক করুন।