- পরমাণু কাকে বলে
- পরমাণুর গঠন, পরমাণুর গঠন ব্যাখ্যা কর
- পরমাণু কে আবিষ্কার করেন
- ভারতের পরমাণু বিজ্ঞানের জনক কে
- পরমাণু ক্রমাঙ্ক কাকে বলে
- পরমাণুর নিউক্লিয়াস কাকে বলে
- রাদারফোর্ডের পরমাণু মডেল
- বোর পরমাণু মডেল, বোরের পরমাণু মডেল
- পরমাণুর সবচেয়ে ভারী কনা কোনটি
- পরমাণুর সবচেয়ে হালকা কণা কোনটি
- পরমাণু চার্জ নিরপেক্ষ কেন
- পরমাণুর ভর সংখ্যা কাকে বলে
- পরমাণু নিস্তড়িত হয় কেন
- অণু কাকে বলে
- অণু ও পরমাণু কাকে বলে, অনু ও পরমাণু কাকে বলে
- অণু ও পরমাণুর মধ্যে পার্থক্য, অণু ও পরমাণুর পার্থক্য
- পরমাণু ও আয়নের মধ্যে পার্থক্য
- FAQ | পরমাণু
পরমাণু কাকে বলে
মৌলিক পদার্থের ক্ষুদ্রতম কণা যার স্বাধীন কোনো অস্তিত্ব নেই, তবে ক্ষুদ্রতম একক হিসেবে রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করে,তাকে পরমাণু বলে। যেমন – O, H, N ইত্যাদি।
আবার বলা যায়, মৌলিক পদার্থের যে ক্ষুদ্রতম কণার মধ্যে মৌলটির সকল ধর্ম উপস্থিত থাকে এবং যেটি রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করে, তাকে পরমাণু বলে। যেমন – হাইড্রোজেন, অক্সিজেন, নাইট্রোজেন, কার্বন ইত্যাদি।
পরমাণুর বৈশিষ্ট্য
- পরমাণু মৌলিক পদার্থের একটি ক্ষুদ্রতম কণা বা একক।
- সাধারণত পরমাণু স্বাধীনভাবে মুক্ত অবস্থায় থাকতে পারে না, তবে কিছু কিছু মৌলিক পদার্থের পরমাণু স্বাধীনভাবে থাকতে পারে। যেমন—হিলিয়াম, নিয়ন, আর্গন ইত্যাদি।
- পরমাণু সরাসরি রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করে।
- বিভিন্ন প্রকার পরমাণুর সংখ্যা সীমিত। এ পর্যন্ত সর্বমোট ১১১ প্রকারের পরমাণু আবিষ্কৃত হয়েছে।
- একটি পরমাণুকে ভাঙলে ওই মৌলের আর কোন অস্তিত্বই থাকে না।
পরমাণুর গঠন, পরমাণুর গঠন ব্যাখ্যা কর
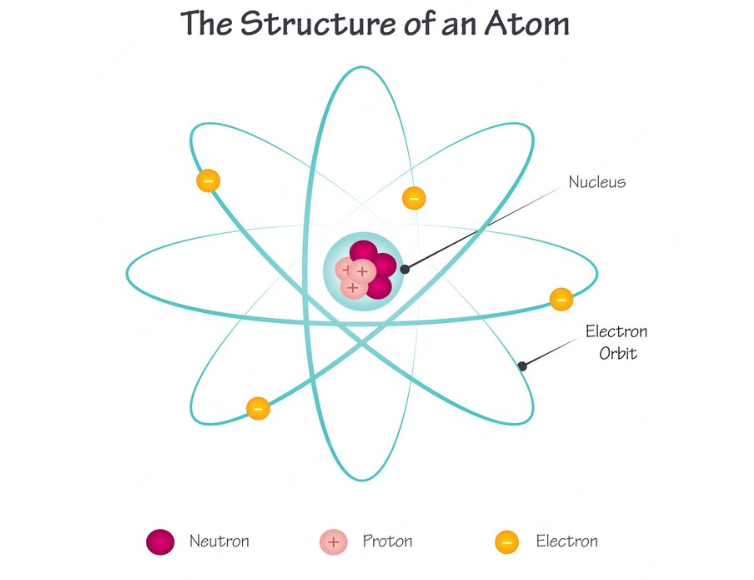
মহাবিশ্বের সবকিছুই পরমাণু দিয়ে গঠিত। প্রতিটি পরমাণুর ভেতরে থাকে একটি নিউক্লিয়াস। এটিই পরমাণুর কেন্দ্র। এখানে অতিক্ষুদ্র প্রোটন ও নিউট্রন গুচ্ছকারে থাকে। এদের ভর ও চার্জের পরিমাণও অতি অল্প। সে কারণে সাধারণত তাদের ভর ও চার্জের তুল্যমান দিয়ে হিসাব করা হয়। যেমন প্রোটনের আপেক্ষিক চার্জ ধরা হয় +১ এবং নিউট্রনের আপেক্ষিক চার্জ ০। এই দুটি কণা মিলেই পরমাণুর সিংহভাগ ভর গঠন করে। তবে একটি পরমাণুর মোট ব্যাসের তুলনায় তারা খুব অল্প জায়গা দখল করে থাকে। পরমাণুর বাকি জায়গা থাকে ইলেকট্রনের দখলে। এই অতিক্ষুদ্র কণার আপেক্ষিক চার্জ -১। প্রোটনের ধনাত্মক চার্জকে ভারসাম্যে আনতে ইলেকট্রনের এই ঋণাত্মক চার্জ যথেষ্ট। নিউক্লিয়াসের চারপাশে ঘোরাঘুরি করে ইলেকট্রন।
প্রোটন ও নিউট্রন গঠিত হয় আরও ক্ষুদ্র কণা কোয়ার্ক দিয়ে। একটি প্রোটন দুটি আপ কোয়ার্ক ও একটি ডাউন কোয়ার্ক দিয়ে গঠিত। অন্যদিকে দুটি ডাউন কোয়ার্ক ও একটি আপ কোয়ার্ক মিলে গঠন করে নিউট্রন। কোয়ার্কগুলো গ্লুয়ন নামের একটি বলবাহী কণার মাধ্যমে পরস্পরের সঙ্গে যুক্ত থাকে।
পরমাণুর কেন্দ্রে নিউক্লিয়াস থাকে এবং নিউক্লিয়াস ধনাত্মক চার্জবিশিষ্ট প্রোটন এবং চার্জবিহীন নিউট্রন দ্বারা গঠিত। এছাড়া পরমাণুর প্রায় সমস্ত অংশই ফাঁকা থাকে। পরমাণুর সকল ধনাত্মক আধান এবং ভর নিউক্লিয়াসে কেন্দ্রীভূত থাকে। পরমাণুতে ইলেকট্রন নামক আরো এক ধরনের মৌলিক কণিকা থাকে যেটি পরমাণুর সবচেয়ে হালকা মৌলিক কণিকা। তবে এর চার্জ ঋণাত্মক।
নিউজিল্যান্ডের বিজ্ঞানী রাদারফোর্ড 1911 সালে আলফা কণা পরীক্ষার মাধ্যমে পরমাণুর নিউক্লিয়াস আবিষ্কার করেন। প্রতিটা পরমাণু বৈদ্যুতিকভাবে চার্জ নিরপেক্ষ থাকে কারণ পরমাণুতে সমান সংখ্যক ইলেকট্রন এবং প্রোটন থাকে। তবে পরমাণু থেকে ইলেকট্রনকে সহজে বের করে আনা গেলেও প্রোটনকে সহজে বের করা যায় না। এছাড়া পরমাণুতে ইচ্ছা করলে ইলেকট্রনকে বাইরে থেকে এনে যুক্ত করা যায় আবার ইলেকট্রনকে পরমানু থেকে টেনে বাইরেও বের করে আনা যায়। পরমাণু থেকে ইলেকট্রনকে সরিয়ে ফেললে সেই পরমাণুটি পজেটিভ চার্জযুক্ত হয় এবং পরমাণুতে ইলেকট্রনকে বাইরে থেকে এনে যুক্ত করলে সেটি নেগেটিভ চার্জযুক্ত হয়।
পরমাণু থেকে ইলেকট্রন নির্গত হওয়ার প্রধান কারনগুলো হল – ঘর্ষণ,তাপ,রাসায়নিক বিক্রিয়া ইত্যাদি। কোনো রাসায়নিক বিক্রিয়ায় শুধুমাত্র পরমাণু অংশগ্রহণ করে,কখনো অণু অংশগ্রহণ করে না।
পরমাণুর গঠন নিয়ে বিজ্ঞানীরা অনেক অনেক গবেষণা করেছেন। এর মাঝে অন্যতম হচ্ছে ডাল্টনের পরমাণুবাদ। ডাল্টনের পরমাণুবাদে পরমাণুকে অবিভাজ্য হিসেবে ধরা হয়েছে। তবে বর্তমানে এ তত্ত্বের কোন ভিত্তি নেই। ঊনবিংশ শতাব্দীর শেষের দিকে প্রমাণিত হয় যে, পরমাণু তিনটি উপাদান নিয়ে গঠিত। এগুলো হলো –
- ইলেকট্রন
- প্রোটন এবং
- নিউট্রন
এরা বিভিন্ন সংখ্যায় একসাথে হয়ে নানা ধরণের পরমাণু গঠন করে। ধনাত্মক আধানযুক্ত প্রোটন এবং আধানবিহীন নিউট্রন একত্রিত হয়ে নিউক্লিয়াস গঠন করে। আর এদেরকে ঘিরে ঘুরছে ঋণাত্মক আধানের ইলেকট্রন। নিম্নে এ ৩ টি উপাদান সম্পর্কে আলোচনা করা হলো –
ইলেকট্রন কাকে বলে
পরমাণুর একটি মূল কণিকা হলো ইলেকট্রন। এটি একটি অধঃ-পরমাণু (subatomic) মৌলিক কণা (elementary particle) যা একটি ঋণাত্মক তড়িৎ আধান বহন করে।
সর্বপ্রথম এর নামকরণ করেন স্টোনি। স্যার জে.জে. থমসন ১৮৯৭ খ্রিস্টাব্দে সর্বপ্রথম ইলেকট্রনের অস্তিত্ব আবিষ্কার করেন। এটি নিউক্লিয়াসের চারদিকে ঘুরে। এর বৈশিষ্ট্য হলো –
- ভর – 9.1085×10−28g
- আধান – -1.6×10−19 কুলম্ব
- প্রতীক – e
- amu তে ইলেক্ট্রনের ভর – 0.000549 amu
প্রোটন কাকে বলে
কোন পরমাণুর নিউক্লিয়াসের ভেতর যে ধণাত্বক আধানযুক্ত ক্ষুদ্র কণিকা দেখা যায়, তাকে প্রোটন বলে। এটি ধনাত্মক আধান বিশিষ্ট একটি কণিকা। এটি নিউক্লিয়াসের ভিতরে থাকে।
আর্নেস্ট রাদারফোর্ড ১৯১১ খ্রিস্টাব্দে প্রোটনের অস্তিত্ব প্রমাণ করেন। একটি পরমাণুতে ইলেকট্রনের সমান সংখ্যক প্রোটন থাকে। প্রোটন নিয়ে গুরুত্বপূর্ণ কিছু তথ্য –
- প্রোটনের ভরঃ 1.673×10−24g বা 1.673−27kg
- পারমাণবিক ভর স্কেল অনুসারেঃ 1.007276 amu
- প্রতীক – P
নিউট্রন কাকে বলে
ইলেকট্রন ও প্রোটনের ন্যায় নিউট্রনও হচ্ছে পরমানুর ক্ষুদ্রতম একটি কনিকা যা নিউক্লিয়াসের ভেতরে অবস্থান করে। এটি চার্জ নিরপেক্ষ। এটি পরমাণুর কেন্দ্রে প্রোটনের সাথে যুক্ত থাকে। জেমস চ্যাডউইক ১৯৩২ সালে নিউট্রন আবিষ্কার করেন। নিউট্রনের গুরুত্বপূর্ণ কিছু তথ্য –
- ভরঃ 1.675×10−24g
- পারমাণববিক ভর স্কেল অনুসারেঃ 1.008665 amu
- প্রতীকঃ n
- এর ভর ইলেকট্রনের ভরের প্রায় 1837 গুণের সমান
পরমাণুর গঠন চিত্র
পরমাণু কে আবিষ্কার করেন
ভারতীয় দার্শনিক কণাদ খ্রীস্টের জন্মের ৬০০ বছর আগে পরমাণুর ধারণা দেন । তিনি বলেন সকল পদার্থই ক্ষুদ্র এবং অবিভাজ্য কণিকা দ্বারা তৈরী।
পরমাণু তত্ত্ব গ্রিক দার্শনিকেরা পরীক্ষা ও পর্যবেক্ষণ ব্যবহার করে নয়, বরং দার্শনিক দৃষ্টিভঙ্গি থেকে পদার্থের তত্ত্ব নির্মাণের চেষ্টা করেন। এ ধারার প্রথম দার্শনিক ছিলেন মিলেতুসের লেউকিপ্পুস (খ্রিস্টপূর্ব ৫ম শতাব্দী)। তার বিখ্যাত শিষ্য আবদেরার ডেমোক্রিটাস খ্রিষ্টপূর্ব ৪০০অব্দে পদার্থ যেসব অতিক্ষুদ্র অবিভাজ্য কণা দিয়ে গঠিত তাদের নাম দেন ‘এটমস'(গ্রিক: Atomos), যার আক্ষরিক অর্থ “অবিভাজ্য”।
ভারতের পরমাণু বিজ্ঞানের জনক কে
হোমি জাহাঙ্গীর ভাবাকে ‘ভারতীয় পারমাণবিক কর্মসূচির জনক’ বলা হয়। তিনি একজন ভারতীয় পরমাণু পদার্থবিদ ছিলেন যিনি ভাবা অ্যাটমিক রিসার্চ সেন্টার এবং টাটা ইনস্টিটিউট অফ ফান্ডামেন্টাল রিসার্চ প্রতিষ্ঠা করেছিলেন।
পরমাণু ক্রমাঙ্ক কাকে বলে
কোনাে মৌলের পরমাণুর নিউক্লিয়াসে যতগুলি প্রােটন থাকে , সেই সংখ্যাকে ওই মৌলের পারমাণবিক সংখ্যা বা পরমাণু ক্রমাঙ্ক বলে ।
কোন মৌলের পারমাণবিক সংখ্যা বা পরমাণু ক্রমাঙ্ক বলতে ওই পরমাণুর নিউক্লিয়াসে অবস্থিত পজিটিভ তড়িৎ এর মোট একক-সংখ্যা বোঝায়।
কোন মৌলের পরমাণুর নিউক্লিয়াসের যত সংখ্যক প্রোটন থাকে সেই সংখ্যাকে ওই মৌলের পরমাণু ক্রমাঙ্ক বা পারমাণবিক সংখ্যা বলে। অর্থাৎ – মৌলের পরমাণু ক্রমাঙ্ক বা পারমাণবিক সংখ্যা (Z) = পরমাণুর প্রোটন সংখ্যা। যেমন অক্সিজেনের পারমাণবিক সংখ্যা 8 ; অর্থাৎ অক্সিজেন পরমানুতে একটি প্রোটন আছে।
যেহেতু, পরমাণু নিস্তড়িত তাই পরমাণুর মোট পজিটিভ চার্জ = মোট নেগেটিভ চার্জ অর্থাৎ পরমাণুর নিউক্লিয়াসের প্রোটন সংখ্যা এবং নিউক্লিয়াসের বাইরের মোট ইলেকট্রন সংখ্যা পরস্পর সমান হবে।
প্রোটন সংখ্যা = নিউক্লিয়াসের বাইরে বিভিন্ন কক্ষে ইলেকট্রনের মোট সংখ্যা।
অতএব, বলা যায় যে মৌলের পরমাণু ক্রমাঙ্ক বা পারমাণবিক সংখ্যা = নিউক্লিয়াসের প্রোটন সংখ্যা = নিউক্লিয়াসের বাইরে বিভিন্ন কক্ষে ইলেকট্রনের মোট সংখ্যা।
পরমাণুর নিউক্লিয়াস কাকে বলে
পরমাণুর কেন্দ্রে অবস্থিত একটি ক্ষূদ্রতম অংশ যার মধ্যে পরমাণুর সমস্ত ধনাত্মক আধান ও ভর অবস্থান করে তাকে পরমাণুর নিউক্লিয়াস বলে।
N হল পরমাণুর নিউক্লিয়াস।
নিউক্লিয়াস ধনাত্মক আধান যুক্ত কণিকা প্রোটন এবং তড়িৎ নিরপেক্ষ কণিকা নিউট্রন দ্বারা গঠিত।
রাদারফোর্ডের পরমাণু মডেল
১৯১১ খ্রিস্টাব্দে বিজ্ঞানী আর্নেস্ট রাদারফোর্ড পরমাণুর গঠন সম্পর্কে একটি মডেল প্রদান করেন। এই মডেলটি রাদারফোর্ডের পরমাণু মডেল নামে পরিচিত। মডেলটি নিম্নরূপ :
- i. পরমাণুর একটি কেন্দ্র আছে। এই কেন্দ্রের নাম নিউক্লিয়াস।নিউক্লিয়াসের ভেতরে প্রোটন এবং নিউক্লিয়াসের বাইরে ইলেকট্রন অবস্থান করে। যেহেতু আপেক্ষিকভাবে ইলেকট্রনের ভর শূন্য ধরা হয়, কাজেই নিউক্লিয়াসের ভেতরে অবস্থিত প্রোটন ও নিউট্রনের ভরই পরমাণুর ভর হিসেবে বিবেচনা করা হয়।
- ii. নিউক্লিয়াস অত্যন্ত ক্ষুদ্র এবং পরমাণুর ভেতরে বেশির ভাগ জায়গা ফাঁকা।
- iii. সৌরজগতে সূর্যকে কেন্দ্র করে বিভিন্ন কক্ষপথে যেমন গ্রহগুলো ঘোরে, তেমনি নিউক্লিয়াসকে কেন্দ্র করে বিভিন্ন কক্ষপথে ইলেকট্রনগুলো ঘুরছে।কোনো পরমাণুর নিউক্লিয়াসে যে কয়টি প্রোটন থাকে নিউক্লিয়াসের বাইরে সেই কয়টি ইলেকট্রন থাকে। যেহেতু প্রোটন ও ইলেকট্রনের চার্জ একে অপরের সমান ও বিপরীত চিহ্নের, তাই পরমাণু সামগ্রিকভাবে চার্জ শূন্য।
- iv. ধনাত্মক চার্জবাহী নিউক্লিয়াসের প্রতি ঋণাত্মক চার্জবাহী ইলেকট্রন এক ধরনের আকর্ষণ বল অনুভব করে। এই আকর্ষণ বল কেন্দ্রমুখী এবং এই কেন্দ্রমুখী বলের কারণে পৃথিবী যে রকম সূর্যের চারদিকে ঘুরে, ইলেকট্রন সে রকম নিউক্লিয়াসের চারদিকে ঘুরে।
রাদারফোর্ডের পরমাণু মডেলের ত্রুটি
রাদারফোর্ডের মডেল সৌরজগতের মতো।কিন্তু রাদারফোর্ড নির্দিষ্ট কোন কক্ষপথের কথা বলেননি।এটাই ছিল রাদারফোর্ডের ত্রুটি। বিজ্ঞানী বোর পরবর্তীকালে ধারণা দেন যে,ঋণাত্মক আধানযুক্ত কণা কিছু নির্দিষ্ট কক্ষপথে ঘুরে।
রাদারফোর্ডের পরমাণু মডেলের প্রধান দুটি অসঙ্গতি দেখা যায়। যেমন—
বিজ্ঞানী নীলস বোর (Niels Bohr) জানান যে, ধনাত্মক চার্জ বাহী নিউক্লিয়াসকে কেন্দ্র করে ঋণাত্মক কার্যবাহী ইলেকট্রনগুলি বৃত্তাকার পথে আবর্তন করতে থাকলে তড়িৎ গতিবিদ্যার নিয়ম অনুযায়ী এগুলো থেকে সর্বদা শক্তি বিকিরণ হতে থাকবে। ফলে ইলেকট্রনগুলি শক্তি হারাবে এবং ঘুরতে ঘুরতে ক্রমশ নিউক্লিয়াসের দিকে এগিয়ে যাবে। একসময় ইলেকট্রনগুলি নিউক্লিয়াসের ওপর গিয়ে পড়বে। অর্থাৎ, পরমাণুর আর কোনাে ইলেকট্রনীয় গঠন থাকবে না। কিন্তু প্রকৃতপক্ষে তা হয় না যা রাদারফোর্ডের পরমাণু মডেলের একটি ত্রুটি।
নিউক্লিয়াসের চারদিকে ইলেকট্রন গুলো অবিরাম ঘুরতে থাকে ওই ঘূর্ণায়মান ইলেকট্রন গুলো থেকে অবিরাম শক্তি বিকীর্ণ হতে থাকে। এর ফলে পরমাণুর যে বর্ণালী পাওয়া যাবে, সেটা সূর্যরশ্মির বর্ণালীর মতে নিরবচ্ছিন্ন হবে। কিন্তু বাস্তবে দেখা যায় পরমাণু রেখা বর্ণালি সৃষ্টি করে। রাদারফোর্ডের পরমাণু মডেল এই ঘটনার ব্যাখ্যা করতে পারে না। যা রাদারফোর্ডের পরমাণু মডেলের অপর একটি ত্রুটি বা সীমাবদ্ধতা।
রাদারফোর্ড পরমাণু মডেলের ভিত্তি কি
রাদারফোর্ডের পরমাণু মডেলের ভিত্তি হলো রাদারফোর্ড কর্তৃক সম্পাদিত আলফা (c) কণা বিচ্ছুরণ পরীক্ষার পর্যবেক্ষণ নির্ভর সিদ্ধান্তসমূহ । রাদারফোর্ড পরমাণু মডেলে পরমাণুর কেন্দ্রে ধনাত্মক চার্জযুক্ত নিউক্লিয়াস থাকে এবং ধনাত্মক চার্জের সমসংখ্যক ঋণাত্মক ইলেকট্রন নিউক্লিয়াসকে কেন্দ্র করে সতত আবর্তনশীল থাকে। রাদারফোর্ড মডেলের রয়েছে সৌরজগতের বিন্যাস প্রকরণ ।
রাদারফোর্ডের পরমাণু মডেলে ইলেকট্রনের কক্ষপথের আকার ও সংখ্যাকে সুস্পষ্ট করা হয়নি। এতে শুধু বলা হয়েছে নিউক্লিয়াসকে কেন্দ্র করে যে কোনো ব্যাসার্ধের বৃত্তাকার কক্ষপথে ইলেকট্রনগুলো গ্রহের মতো আবর্তন করতে পারে।
রাদারফোর্ডের পরমাণু মডেলের স্থায়িত্বের কারণ দেখানো হয়েছে ধনাত্মক চার্জযুক্ত কেন্দ্ৰস্থ নিউক্লিয়াস ও ঋণাত্মক চার্জযুক্ত ইলেকট্রনের মধ্যস্থ স্থির বৈদ্যুতিক আকর্ষণজনিত কেন্দ্রমুখী বল এবং আবর্তনশীল ইলেকট্রনের কেন্দ্রবহির্মুখী ‘বলদ্বয়ের লব্ধিফল ।
রাদারফোর্ড পরমাণু মডেলের সীমাবদ্ধতা
- ১- সৌরজগতে গ্রহসমূহ সামগ্রিকভাবে চার্জহীন অথচ পরমাণুতে আবর্তনশীল ইলেক্ট্রন সমূহ ঋনাত্মক চার্জযুক্ত এবং পরস্পরকে স্থির বৈদ্যুতিক বল দ্বারা বিকর্ষণ করে। অপরদিকে গ্রহসমূহ মহাকর্ষ বল দ্বারা পরস্পরকে আকর্ষণ করে। তাই গ্রহ গুলোর সাথে ইলেক্ট্রনের তুলনা সঠিক হয় নি।
- ২- ম্যাক্সোয়েলের আলো সম্পর্কিয় তড়িৎ চুম্বকীয় তত্তানুসারে কোনো চার্জযুক্ত বস্তু বা কণা কোনো বৃত্তাকার পথে ঘুরলে তা ক্রমাগত ভাবে শক্তি বিকিরন করবে এবং তার আবর্তন চক্র ও ধীরে ধীরে কমতে থাকবে। সুতরাং এক্ষেত্রে কক্ষপথে আবর্তনশীল ঋনাত্মক চার্জযুক্ত ইলেক্ট্রন সমূহ ক্রমশ শক্তি হারাতে হারাতে নিউক্লিয়াসের ওপর পতিত হবে।অর্থাৎ রাদারফোর্ডের পরমাণু মডেল সম্পূর্ণ ভাবে একটি অস্থায়ী অবস্থা হবে, যা কখোনো ই ঘটে না।
- ৩- হাইড্রোজেন পরমাণুর বর্ণালি সম্পর্কে কোন সুষ্ঠ ব্যাখ্যা এ মডেল দিতে পারে নি।
- ৪- আবর্তনশীল ইলেক্ট্রনের কক্ষপথের আকার ও আকৃতি সম্বন্ধে কোনো ধারণা রাদারফোর্ডের পরমাণু মডেলে দেওয়া হয় নি।
- ৫- একাধিক ইলেক্ট্রন বিশিষ্ট পরমাণুতে ইলেক্ট্রন গুলো নিউক্লিয়াস কে কিভাবে পরিক্রমণ করে, তার কোনো উল্যেখ এ মডেলে নেই।
বোর পরমাণু মডেল, বোরের পরমাণু মডেল
1913 খ্রিস্টাব্দে ডেনমার্কের প্রসিদ্ধ বিজ্ঞানী নীলস বোর (Niels Bohr) পরমাণুর এই মডেল প্রস্তাব করেন এবং 1922 খ্রিস্টাব্দে এই আবিষ্কারের জন্য তিনি নোবেল পুরস্কার লাভ করেন। বোর প্রস্তাব করেন যে, চিরায়ত বলবিদ্যা (Classical mechanics) এবং বিদ্যুৎ চুম্বকত্ব (Electromagnetism)-এর সূত্রসমূহ পরমাণুতে বিকল হয়ে (break down) পড়ে।
তিনি মূলত রাদারফোর্ডের নিউক্লীয় পরমাণু মডেলে কোয়ান্টাম তত্ত্ব প্রয়োগ করেন এবং কোয়ান্টাম তত্ত্বের বৈপ্লবিক প্রসারণ ঘটিয়ে পরমাণুর বর্ণালি ব্যাখ্যা করেন। তার নাম অনুসারে পরমাণুর এই মডেলকে বোর পরমাণু মডেল বলা হয়। এই পরমাণু মডেলে তিনি রাদারফোর্ডের পরমাণু মডেলের প্রধান ত্রুটি পরমাণুর স্থায়ী অস্তিত্বসহ অন্যান্য ত্রুটি দূর করার চেষ্টা করেন। এই পর্যায়ে নীলস বোর কোয়ান্টাম তত্ত্ব প্রয়োগ করে সমস্যাটির সমাধান করতে চেষ্টা করেন। তিনি রাদারফোর্ডের পরমাণু মডেলে নিম্নলিখিত মৌলিক স্বীকার্য প্রয়োগ করেন। এই স্বীকার্যগুলোকে বোর-এর স্বীকার্য বলে।
বোর পরমাণু মডেলের স্বীকার্য
ক. – শক্তি স্তর সংক্রান্ত ধারণা
পরমাণুস্থ ইলেকট্রনসমূহ ইচ্ছাকৃত যে কোনো ব্যাসার্ধের কক্ষপথে নিউক্লিয়াসের চারদিকে পরিভ্রমণ করতে পারে না।
পরমাণুতে ইলেকট্রন নিউক্লিয়াসের চারপাশে কতগুলি অনুমোদিত বৃত্তাকার কক্ষপথে পরিভ্রমন করবে।
প্রতিটি কক্ষপথ গুলো নির্দিষ্ট শক্তির হয়ে থাকে। ইলেকট্রন যতক্ষণ একটি স্থির কক্ষপথে অবস্থান করে, ততক্ষণ পর্যন্ত কোন শক্তি শোষণ বা বিকিরণ করবে না।
এ কক্ষপথ গুলোকে শক্তিস্তর বা স্থির কক্ষপথ বা অরবিট বা প্রধান শক্তিস্তর বলে। শক্তিস্তরগুলোকে ’n’ দ্বারা প্রকাশ করা হয়।
n = 1 হলে, প্রধান শক্তিস্তর = K
n = 2 হলে, প্রধান শক্তিস্তর = L
n = 3 হলে, প্রধান শক্তিস্তর = M
n = 4 হলে, প্রধান শক্তিস্তর = N
খ. – কৌণিক ভরবেগ সংক্রান্ত ধারণা
প্রতিটি নির্দিষ্ট শক্তির স্থির কক্ষপথে আবর্তনরত ইলেকট্রন গুলির কৌণিক ভরবেগ h/2π এর অখন্ড গুণিতক।
অর্থাৎ এখানে n = 1, 2, 3…… ইত্যাদি পূর্ণ সংখ্যা হবে, কিন্তু কোন ভগ্নাংশ হবে না।
কৌণিক ভরবেগ (mvr) = nh / 2π
এখানে,
n = প্রধান শক্তিস্তর, ( n এর মান পূর্ণ সংখ্যা 1, 2, 3, 4 ইত্যাদি ),
h = প্লাঙ্কের ধ্রুবক। ( এর মান 6.626×10-³⁴ Js ),
m = ইলেকট্রনের ভর,
v = ইলেকট্রনের রৈখিক বেগ,
r = বৃত্তাকার কক্ষপথের ব্যাসার্ধ।
π = ধ্রুবক এর মান 3.14
গ. – বর্ণালীর সংক্রান্ত / শক্তির বিকিরণ সম্পর্কিত ধারণা
বোর পরমাণুর মডেল অনুসারে ইলেকট্রন বিভিন্ন শক্তিস্তরে ঘূর্ণমান থাকার সময় কোনো শক্তি শোষণ বা বিকিরণ করে না।
পরমাণুকে যখন বাহির থেকে শক্তি প্রদান করা হয় তখন নিম্ন শক্তিস্তরের ইলেকট্রন গুলো শক্তি শোষণ করে উচ্চ শক্তিস্তরে গমন করেন।
আবার যখন শক্তির উৎস সরিয়ে নেওয়া হয় তখন ইলেকট্রনগুলি যে শক্তি শোষণ করে উচ্চ শক্তিস্তরে গমন করেছিল ঠিক সমপরিমাণ শক্তি বিকিরণ করে আবার নিম্ন শক্তিস্তরে ফিরে আসে। এই বিকরিত শক্তি আমরা বর্ণালী হিসেবে দেখতে পায়।
এই শক্তি তাড়িত চৌম্বকীয় তরঙ্গ আকারে নির্গত হয়। দুটি শক্তিস্তরের মধ্যে শক্তির পার্থক্য,
E₂ — E₁ = ΔE = hv.
বোর পরমাণু মডেলের সীমাবদ্ধতা
১. দ্বিমাত্রিক কাঠামো
বোর মডেলের সবচেয়ে বড় ত্রুটি হলো এটি পরমাণুর দ্বিমাত্রিক কাঠামো প্রস্তাব করেছে।
২. সকল বর্ণালি ব্যাখ্যায় অসামর্থ
বোর পরমাণু মডেল হাইড্রোজেন পরমাণুর বর্ণালি ব্যাখ্যা করতে পারলেও এর সাহায্যে বহু ইলেকট্রন বিশিষ্ট পরমাণুর বর্ণালি ব্যাখ্যা করা যায় না।
৩. সূক্ষ্ম রেখার ব্যাখ্যায় সীমাবদ্ধতা
এক শক্তিস্তর থেকে অপর শক্তিস্তরে ইলেকট্রনের প্রতিটি স্থানান্তরে জন্য বোর মডেল অনুসারে বর্ণালিতে এক একটি রেখা পাওয়া যাওয়ার কথা। কিন্তু উচ্চ শক্তির বর্ণালি বীক্ষণের সাহায্যে বিশ্লেষণ করে দেখা গেছে যে, কোন কোন রেখার উপর একাধিক বর্ণালি-রেখা পতি হয়েছে। এসব সূক্ষ্ম রেখার উৎপত্তি কীভাবে হয়েছে তা বোর মডেল ব্যাখ্যা করতে পারে না।
৪. তরঙ্গ ধর্ম ব্যাখ্যায় অপারগতা
বোর মতবাদ অনুসারে পরমাণুতে ইলেকট্রনের শুধু কণা ধর্ম রয়েছে। কিন্তু আইনস্টাইনের মতবাদ অনুসরণ করে বিজ্ঞানী ডি. ব্রগলি দেখিয়েছেন ইলেকট্রনের কণা ধর্মের পাশাপাশি আবার তরঙ্গ ধর্মও রয়েছে।
৫. কৌণিক ভরবেগ
কোনো ব্যাখ্যা ছাড়াই বোর কৌণিক ভরবেগকে mvr = nh/2π হিসেবে প্রকাশ করেছেন।
বোর পরমাণু মডেলের ভিত্তি কি
১. এই মডেল যে সকল পরমাণু বা আয়নে একটি মাত্র ইলেকট্রন থাকে (যেমন- H, He, Li2+) তাদের বর্ণালী ব্যাখ্যা করতে পারলেও একাধিক ইলেকট্রন বিশিষ্ট পরমাণুসমূহের বর্ণলী ব্যাখ্যা করতে পারে না
২. ইলেকট্রন যখন এক শক্তিস্তর হতে অপর শক্তিস্তরে স্থানান্তরিত হয় তখন বোর পরমাণু মডেল অনুসারে বর্ণালিতে একটি করে রেখা সৃষ্টি হওয়ার কথা, কিন্তু বাস্তবে অধিকতর সূক্ষ্ম যন্ত্র দ্বারা পরীক্ষা করলে দেখা যায়, পারমাণবিক বর্ণলির প্রতিটি রেখা একাধিক সূক্ষ্ম রেখায় বিভক্ত হয়ে পড়ে। বোরের মতবাদ এর কোন ব্যাখ্যা দিতে পারে না। অবশ্য পরবর্তীতে বোর মতবাদের সম্প্রসারন করে বিজ্ঞানী সমারফিল্ড এর ব্যাখ্য প্রদান করে।
৩. বোর মতবাদ হাইজেনবার্গ এর অনিশ্চয়তার নীতি, স্টার্ক ফলাফল, জীম্যান ফলাফল ব্যাখ্যা করতে পারে না ।
পরমাণুর সবচেয়ে ভারী কনা কোনটি
পরমাণুর সবচেয়ে হালকা কণা কোনটি
পরমাণুতে সবচেয়ে ভারী কণা নিউট্রন এবং সবচেয়ে হালকা কণা ইলেকট্রন ।
পরমাণু চার্জ নিরপেক্ষ কেন
পরমাণুতে ধনাত্মক চার্জযুক্ত প্রোটন কণা ও ঋণাত্মক চার্জযুক্ত ইলেকট্রন কণার সংখ্যা সমান হয়। ফলে পরমাণুর মোট চার্জ 0 হয়।
যখন বহিঃশক্তির প্রভাবে পরমানুর বহিঃস্থ কক্ষপথে ইলেক্ট্রন এর যোজন বা বিয়োজন ঘটে তখন চার্জ যুক্ত হয়। মূলত কোনো মৌলের পরমানুতে সমান সংখ্যক কেন্দ্রিভূত প্রটন ও বহিঃস্থ কক্ষপথে ঘূর্ণায়মান ইলেক্ট্রন বিদ্যমান থাকে বলে, প্রটন ও ইলেক্ট্রনের বিপরিত ধর্মী চার্জ পরস্পর কে শুন্য করে দেয়। তাই পরমানু শুন্য চার্জের হয়।
পরমাণুর ভর সংখ্যা কাকে বলে
পরমাণুর নিউক্লিয়াসে প্রোটন এবং নিউট্রন অতিক্ষুদ্র স্থানে ঠাসাঠাসি অবস্থায় থাকে। কোন মৌলের একটি পরমাণুর নিউক্লিয়াসের মধ্যে প্রোটন ও নিউট্রনের মোট সংখ্যাকে ওই পরমাণুর ভর সংখ্যা বলে।
পরমাণুর ভর সংখ্যা = প্রোটন সংখ্যা + নিউট্রন সংখ্যা
ইলেকট্রনের ভর নগণ্য, তাই কোন পরমাণুর সমস্ত বার নিউক্লিয়াসের মধ্যে কেন্দ্রীভূত থাকে।
যেমন সোডিয়াম পরমাণুর নিউক্লিয়াসে 11টি প্রোটন এবং 12টি নিউট্রন আছে। সোডিয়ামের ভর সংখ্যা = 11+12 = 23, যেহেতু পরমাণুর মধ্যে প্রোটন এবং নিউট্রন সংখ্যা ভগ্নাংশ হতে পারেনা, এইজন্য ভরসংখ্যা কখনো ভগ্নাংশ হয়না। একটি প্রোটনের ভরকে একক ধরা হয়, আবার একটি নিউট্রনের ভর একটি প্রোটনের ভরের প্রায় সমান। সেই জন্য নিউক্লিয়াসের মধ্যস্থ নিউট্রন ও প্রোটনের মোট সংখ্যাকে ওই পরমাণুর ভর সংখ্যা বলে।
একটি নাইট্রোজেন পরমাণুর প্রকৃত ভর s.i. এককে কত, একটি নাইট্রোজেন পরমাণুর প্রকৃত ভর কত
একটি নাইট্রোজেন পরমাণুর প্রকৃত ভর গ্রাম এককে নির্ণয় করো। নাইট্রোজেনের পারমাণবিক গুরত্ব 14। একটি নাইট্রোজেন পরমাণুর প্রকৃত ভর হলো ১৪.০০৭ ইউনিট ভর S.I. এককে।
পরমাণু নিস্তড়িত হয় কেন
পরমাণুর 3টি কনা থাকে। যথা — প্রোটন , ইলেকট্রন এবং নিউট্রন। একটি পরমাণু তে যতগুলি প্রোটন অর্থাৎধনাত্বক আয়ন থাকে ঠিক ততগুলি ঋনাত্বক আয়ন থাকে । এবং নিউট্রন নিস্তড়িত । ফলে পরমাণু নিস্তড়িৎ হয় ।
পরমাণুতে সাধারণ অবস্থায় প্রোটন এবং ইলেক্ট্রনের সংখ্যা সমান থাকে অর্থাৎ ধনাত্নক ও ঋনাত্নক আধানের পরিমাণ সমান থাকে বিধায় বিপরীত আধান একে অপরকে নিস্ক্রিয় করে দেয়। এর ফলে পরমাণু নিস্তরিৎ হয়।
অণু কাকে বলে
যে মৌলিক বা যৌগিক পদার্থের ক্ষুদ্রতম কণা স্বাধীন ভাবে থাকে এবং সেই পদার্থের সমস্ত ধর্ম বজায় রাখে, সেই মৌলিক বা যৌগিক পদার্থকে অনু বলে।
দুই বা দুইয়ের অধিক সংখ্যক পরমাণু পরস্পরের সাথে রাসায়নিক বন্ধনের মাধ্যমে যুক্ত থাকলে তাকে অণু বলে।
অণু ও পরমাণু কাকে বলে, অনু ও পরমাণু কাকে বলে
দুই বা দুইয়ের অধিক সংখ্যক পরমানু পরস্পরের সাথে যুক্ত হলে, তাকে অনু বলে।
এবং মৌলিক পদার্থের ক্ষুদ্রতম কণা যার মধ্যে মৌলের গুণাগুণ থাকে, তাকে পরমানু বলে।
পরমানু হচ্ছে সে সকল মৌলিক পদার্থ যাদের ভাঙ্গলে ইলেকট্রন, প্রোটন, নিউট্রন পাওয়া যায়। যেমন, অক্সিজেন পরমাণুকে ভাঙ্গলে আমরা ইলেকট্রন, প্রোটন ও নিউট্রন পাবো।
আর অণু হচ্ছে সে সকল যৌগিক পদার্থ যাদের ভাঙ্গলে এক বা একাধিক পরমাণু বা মৌলিক পদার্থ পাওয়া যাবে। যেমন, আপনি যদি পানিকে ভাঙ্গেন তাহলে পাবেন, ১টি অক্সিজেন ও দুটি হাইড্রোজেন। আবার অক্সিজেন ও অণু আকারে থাকে যেমন, O2 এখানে অক্সিজেন কিন্তু অণু, যাকে ভাঙ্গলে দুটি অক্সিজেন পাওয়া যাবে। আবার সেই দুটি অক্সিজেন থেকে একটিকে ভাঙ্গলে পাবেন ইলেকট্রন, প্রোটন ও নিউট্রন, যাকে আমরা সঙ্গা অনুসারে বলবো পরমাণু।
পরমাণু ঃ মৌলিক পদার্থের ক্ষুদ্রতম কণা যার মধ্যে মৌলের গুণাগুণ থাকে এবং যা রাসায়নিক বিক্রিয়ায় অংশ গ্রহন করে তাকে পরমাণু বলে। যেমন – কার্বন পরমাণুতে কার্বনের ধর্ম বিদ্যামান।
- পরমাণু মৌলিক পদার্থের ক্ষুদ্রতম কণা।
- সাধারণত পরমাণু স্বাধীনভাবে মুক্ত অবস্থায় থাকতে পারে না, তবে কোনো কোনো মৌলিক পদার্থের পরমাণু স্বাধীনভাবে থাকতে পারে। যেমন—হিলিয়াম, নিয়ন, আর্গন ইত্যাদি।
- পরমাণু সরাসরি রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করে।
- বিভিন্ন প্রকার পরমাণুর সংখ্যা সীমিত। এ পর্যন্ত ১১১ প্রকারের পরমাণু আবিষ্কৃত হয়েছে।
- পরমাণুকে ভাঙলে ওই মৌলের আর অস্তিত্ব থাকে না।
অণু ঃ দুই বা দুইয়ের অধিক সংখ্যক পরমাণু পরস্পরের সাথে রাসায়নিক বন্ধনের মাধ্যমে যুক্ত থাকলে তাকে অণু বলে।
যেমন – হাইড্রোক্লোরিক এসিডে একটি H পরমাণুর সাথে একটি Cl পরমাণু যুক্ত হয়ে HCl অণু গঠিত হয়।
আবার পানিতে দুটি H পরমাণুর সাথে একটি O পরমাণু যুক্ত হয়ে H₂O অণু গঠিত হয়।
- অণু মৌলিক বা যৌগিক পদার্থের ক্ষুদ্রতম কণা।
- অণু স্বাধীনভাবে মুক্ত অবস্থায় থাকতে পারে।
- অণু সরাসরি রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করে না। রাসায়নিক বিক্রিয়ায় অংশগ্রহণের পূর্বে অণু পরমাণুতে বিশ্লিষ্ট হয়।
- পৃথিবীতে যৌগিক পদার্থের সংখ্যা অসংখ্য বলে অণুর সংখ্যাও অসংখ্য।
- অণুকে ভাঙলে একই বা ভিন্ন মৌলের পরমাণু পাওয়া যায়।
অণু ও পরমাণুর মধ্যে পার্থক্য, অণু ও পরমাণুর পার্থক্য
| অণু | পরমাণু |
| মৌলিক ও যৌগিক পদার্থের ক্ষুদ্রতম কণা, যার মধ্যে ঐ পদার্থের সকল বৈশিষ্ট্য বিদ্যমান থাকে তাই অণু। | মৌলিক পদার্থের ক্ষুদ্রতম কণা যার স্বাধীন কোনো অস্তিত্ব নেই, তবে ক্ষুদ্রতম একক হিসেবে রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করে,তাকে পরমাণু বলে। |
| মৌলিক ও যৌগিক পদার্থের ক্ষুদ্রতম কণা। | মৌলিক পদার্থের ক্ষুদ্রতম কণা। |
| অণুর স্বাধীন সত্তা আছে। | পরমাণুর স্বাধীন সত্তা নেই। |
| অণু সরাসরি রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করতে পারে না। | পরমাণু সরাসরি রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করতে পারে। |
| অণুতে মৌলিক ও যৌগিক পদার্থের ধর্ম উপস্থিত থাকে। | পরমাণুতে মৌলিক পদার্থের ধর্ম উপস্থিত থাকে। |
| অণুর সংখ্যা অসীম। | পরমাণুর সংখ্যা ১১৪টি। |
| উদাহরণ- H2, H2O ইত্যাদি। | উদাহরণ – H (হাইড্রোজেন), O (অক্সিজেন), N (নাইট্রোজেন) ইত্যাদি। |
পরমাণু ও আয়নের মধ্যে পার্থক্য
মৌলের মূল উপাদান ইলেকট্রন প্রোটন ও নিউট্রন দ্বারাই একটি পরমাণু তৈরি হয়। কিন্তু একটি ইলেকট্রনের যুক্ত হওয়া বা বর্ধিত হওয়া আয়ন পরমাণুর রাসায়নিক ধর্মের কিছু পরিবর্তন ঘটায়। অর্থাৎ পরমাণু ও আয়নের মধ্যে পার্থক্য তৈরী হয়। নিচে পরমাণু ও আয়নের মধ্যে পার্থক্য আলোচনা করা হলো।
| পরমাণু | আয়ন |
| পরমাণুর তড়িৎ নিরপেক্ষ কণা। | আয়ন ধনাত্মক বা ঋণাত্মক তড়িৎগ্রস্ত কণা। |
| পরমাণুতে প্রোটন এবং ইলেকট্রন সংখ্যা সমান থাকে। | আয়নে প্রোটন এবং ইলেকট্রন সংখ্যা সমান থাকে না। ক্যাটায়নের ক্ষেত্রে মোট ইলেকট্রন সংখ্যা পরমাণু কেন্দ্রের প্রোটন সংখ্যার অপেক্ষা কম হয়। এবং অ্যানায়নের ক্ষেত্রে মোট ইলেকট্রনের সংখ্যা পরমাণুকেন্দ্র এর প্রোটন সংখ্যা অপেক্ষা বেশি হয়। |
| আয়নের চেয়ে পরমাণু কম সুস্থিত। | পরমাণুর চেয়ে আয়ন বেশি সুস্থিত। কারণ আয়ন নিকটবর্তী নিষ্ক্রিয় গ্যাসের ইলেকট্রন বিন্যাস লাভ করে। যেমন সোডিয়াম আয়নের ইলেকট্রন বিন্যাস নিষ্ক্রিয় গ্যাস নিয়নের অনুরূপ। |
| জলীয় দ্রবণে পরমাণু স্বাধীনভাবে থাকতে পারে আবার নাও পারে। | জলীয় দ্রবণে আয়ন স্বাধীনভাবে থাকতে পারে। |
| সোডিয়াম, ক্যালসিয়াম, ক্লোরিন, অক্সিজেন প্রভৃতি মৌলের পরমাণুকে যথাক্রমে Na, Ca, Cl, O, চিহ্ন দ্বারা প্রকাশ করা হয়। | সোডিয়াম ক্যালসিয়াম ক্লোরিন অক্সিজেন প্রভৃতি মৌলের আয়নকে বোঝাতে যথাক্রমে Na+, Ca+, Cl-,O-2 চিহ্ন ব্যবহার করা হয়। |
আরো অন্যান্য অতি জনপ্রিয় প্রশ্নোত্তর সম্পর্কে জানার জন্য এখানে ক্লিক করুন FAQ | পরমাণু
Q1. পরমাণু কি, পরমাণু কী
Ans – যে কোন মৌলিক পদার্থের ক্ষুদ্রতম (smallest), অবিভাজ্য (indivisible) কণা যারা রাসায়নিক বিক্রিয়ার অংশগ্রহণ করে তাদের বলে পরমাণু (atom)।
কোন মৌলের পরমাণুকে চিহ্নের (symbol) র সাহায্যে প্রকাশ করা হয়। যেমন কার্বনের চিহ্ন C, নাইট্রোজেনের চিহ্ন: N. সালফারের চিহ্ন: S.
Q2. তেজস্ক্রিয় রশ্মি পরমাণুর কোন অংশ থেকে নির্গত হয়, তেজস্ক্রিয় পরমাণুর কোন অংশ থেকে বিটা কণা নির্গত হয়
Ans – তেজস্ক্রিয় মৌলের পরমাণুর নিউক্লিয়াস থেকে আলফা ও বিটা কণা নির্গত হয়।
Q3. পরমাণু বোমা কে আবিষ্কার করেন
Ans- মার্কিন বিজ্ঞানী রবার্ট ওপেনহাইমার ১৯৪৫ সালে পারমাণবিক বোমা আবিস্কার করেন।
Q4. নিউট্রন বিহীন একটি পরমাণুর নাম
Ans – হাইড্রোজেন এর পারমানবিক সংখ্যা 1. অর্থ্যাৎ হাইড্রোজেন নিউক্লিয়াসে শুধুমাত্র একটি প্রোটন থাকে এবং হাইড্রোজেন পরমানুতে কোনো নিউট্রন থাকে না।
Q5. পরমাণুর ব্যাস মাপা হয় কোন এককে
Ans – আলোর তরঙ্গদৈর্ঘ্য, অণু-পরমাণুর মধ্যকার দূরত্ব বা ব্যাস, ক্রিস্টাল বা স্ফটিকের তলগুলোর মধ্যকার দূরত্ব, কোষের বিভিন্ন পরিমাপ, ইত্যাদি ক্ষেত্রে দৈর্ঘ্য প্রকাশের জন্য অ্যাংস্ট্রম একক ব্যবহার করা হয়।
Q6. পরমাণুর স্থায়ী কণিকা কয়টি
Ans – স্থায়ী মূল কণিকা হচ্ছে – ইলেকট্রন, প্রোটন এবং নিউট্রন।
Q7. পরমাণুর অস্থায়ী কণিকা কয়টি
Ans – যে সকল কণিকা কোনো কোনো মৌলের পরমাণুতে ক্ষণস্থায়ীভাবে অবস্থান করে তাকে অস্থায়ী মূল কণিকা (Temporary Core Particle) বলে। অস্থায়ী কণিকার মধ্যে উল্লেখযোগ্য হলো পজিট্রন, মেসন, পাইওন, মিউওন, নিউট্রিনো, এন্টিনিউট্রিনো ইত্যাদি।
Q8. পরমাণুতে কখন বর্ণালীর সৃষ্টি হয়
Ans – কোনো পরমানুর নিউক্লিয়াস কে কেন্দ্র করে ঘুরতে থাকা ইলেকট্রন যখন নিম্ন শক্তিস্তর থেকে উচ্চ শক্তিস্তর এ যায় তখন শক্তি শোষিত হয় এবং অপরদিকে ইলেকট্রন যখন উচ্চ শক্তিস্তর থেকে নিম্ন শক্তিস্তর এ যায় তখন শক্তি বিকিরিত হয়,এই যে,যখন শক্তির শোষণ বা বিকিরণ ঘটে তখন সরু সূক্ষ্ম রেখার সৃস্টি হয়, আর এই রেখাগুলোকে বর্ণালী বলে।এভাবেই বর্ণালী সৃষ্টি হয়।
Q9. অণু কি, অণু কী
Ans – দুই বা দুইয়ের অধিক সংখ্যক পরমাণু পরস্পরের সাথে রাসায়নিক বন্ধনের মাধ্যমে যুক্ত থাকলে তাকে অণু বলে। যে মৌলিক বা যৌগিক পদার্থের ক্ষুদ্রতম কণা স্বাধীন ভাবে থাকে এবং সেই পদার্থের সমস্ত ধর্ম বজায় রাখে, সেই মৌলিক বা যৌগিক পদার্থকে অনু বলে।
Q10. অণুবীক্ষণ যন্ত্র কে আবিষ্কার করেন
Ans – প্রথমদিককার অণুবীক্ষণ যন্ত্র তৈরি হয়েছিল ১৫৯০ সালে নেদারল্যান্ড-এর মিডেলবার্গে । আর প্রথমদিককার অণুবীক্ষণ যন্ত্র আবিষ্কারের কৃতিত্ব দেয়া হয় আই গ্লাস প্রস্তুতকারী হ্যান্স লিপারশে এবং জ্যাচারিয়াস জনসেনকে। তবে অণুবীক্ষণ যন্ত্র আবিষ্কারের সবচেয়ে গুরুত্বপূর্ণ অবদানটি রাখেন অ্যান্টনি ভন লিউয়েনহোয়েক। তিনি তামার পাতের একটি নল তৈরি করে তার মধ্যে একটি লেন্স পুরে দিলেন। এতে ছোট জিনিসকে বড় করে দেখার সুবিধা হলো অনেক।
এরপর নলের মধ্যে একটি লেন্সের বদলে দুটি লেন্স দিলেন। এভাবে এগিয়ে চলল তার পরীক্ষা। বহু পরীক্ষÑনিরীক্ষার পর লিউয়েরহোয়েক আবিষ্কার করলেন একটি যন্ত্র। এ যন্ত্রটির মাধ্যমে অতি ক্ষুদ্র ক্ষুদ্র পদার্থ দেখা গেল অনায়াসে। সেই থেকেই শুরু হলো অণুবীক্ষণ যন্ত্রের যাত্রা, যা পরবর্তীতে আরও উন্নত হয়ে আজকের আধুনিক অণুবীক্ষণ যন্ত্রে এসে পৌছেছে।
আপনি কি চাকরি খুজঁছেন, নিয়মিত সরকারি ও বেসরকারি চাকরির সংবাদ পেতে ক্লিক করুন। বিভিন্ন সরকারি ও বেসরকারি ক্ষেত্রে মানব সম্পদ উন্নয়ন সংক্রান্ত প্রতিবেদন পাড়ার জন্য, ক্লিক করুন। হিন্দিতে শিক্ষামূলক ব্লগ পড়তে, এখানে ক্লিক করুন। এছাড়াও, স্বাস্থ, টেকনোলজি, বিসনেস নিউস, অর্থনীতি ও আরো অন্যান্য খবর জানার জন্য, ক্লিক করুন। 



